Ключевые слова статьи: ботулотоксина, практике, клинической, использования, возможности
История вопроса и механизм действия ботулотоксина
“Загадочная молекула века” – такой эпитет ботулинический токсин заслужил от мирового неврологического сообщества в 2000 году – ровно за тысячелетнюю историю с начала борьбы с ним, а в последние годы – в связи с эффективным его применением для лечения больных с самыми разными заболеваниями.
Clostridium botulinum – анаэробная бактерия, продуцирующая теплоустойчивые споры, которые, прорастая, вырабатывают токсин, называемый ботулиническим токсином.
Ботулизм – тяжелое инфекционное заболевание, проявляющееся периферическими параличами мышц и вегетативными расстройствами вследствие нарушения периферической холинергической медиации, вызываемого ботулиническим нейротоксином. Название “ботулизм” или “колбасное отравление” произошло от латинского слова botulus, что обозначает “черная (кровяная) колбаса”. В настоящее время известны 8 серологических подтипов ботулинического токсина: A, B, C1, C2, D, E, F, G.
Ботулизм у человека могут вызывают серотипы A, B, E, F, G, но самым сильнодействующим является тип А. Как в своей природной форме, так и в виде лекарственных форм, ботулинический токсин представляет собой смесь различных белков. Основные составные их части – нейротоксин (биологически активный компонент ботулотоксина) и нетоксичные протеины, стабилизирующие молекулу нейротоксина (рис. 1). Аминокислотный состав нейротоксина типа А расшифрован, в легкой цепи содержится 448 аминокислот, в тяжелой – 848. Другие серотипы ботулотоксина (от B до G) отличаются количеством и последовательностью аминокислот, главным образом, в легкой цепи.
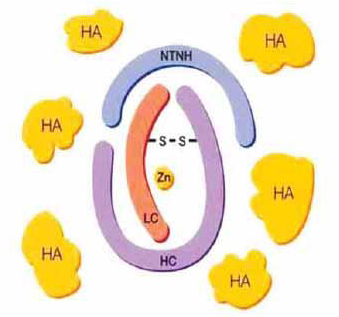
Принципиальный механизм действия всех типов ботулинических токсинов заключается в пресинаптической блокаде транспортных белков, обеспечивающих транспорт везикул ацетилхолина через кальциевые каналы нервной терминали периферического холинергического синапса с последующим выбросом ацетилхолина в синаптическую щель. Ацетилхолин является медиатором в синапсах парасимпатической нервной системы, некоторых синапсах ЦНС, в соматических двигательных и преганглионарных симпатических нервных окончаниях. Холинорецепторы находятся в скелетных и гладких мышцах, внутренних органах, симпатических и парасимпатических ганглиях. Особым видом холинорецепторов являются Н-холинорецепторы афферентных окончаний, расположенных в вегетативных ганглиях, где они, по существу, являются рецепторами сенсорного волокна.
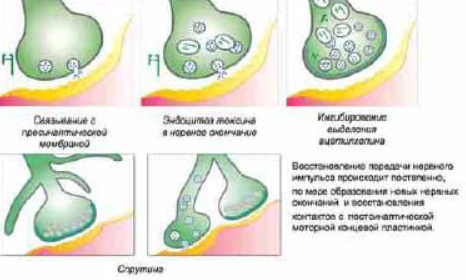
При внутримышечной инъекции ботулотоксина развиваются 2 эффекта: прямое ингибирование a-мотонейронов на уровне нервно-мышечного синапса и ингибирование g-мотонейронного холинергического синапса на интрафузальном волокне. Клинически это проявляется в выраженном расслаблении инъецированных мышц и значительном уменьшении боли в них. При внутрикожной инъекции развивается блокада постганглионарных симпатических нервов на 6-8 месяцев и прекращается потоотделение.
При локальном введении в терапевтических дозах ботулотоксин не проникает через гематоэнцефалический барьер и не вызывает существенных системных эффектов. По-видимому, имеется минимальный пресинаптический захват и обратный аксональный транспорт из места его введения, что может служить основой для проявления дистантных эффектов препарата. Процесс пресинаптического расщепления транспортных белков ботулотоксином является необратимым и занимает в среднем 30-60 минут, поэтому специфический ботулинический антитоксин эффективен лишь в течение часа после поступления токсина к органам-мишеням. Несмотря на то, что клеточные эффекты развиваются очень быстро и необратимо, клиническое миорелаксирующее действие препарата после проведенной инъекции начинает проявляться через несколько дней: в мелких мышцах лица, гортани, кисти – через 2-7 дней, в крупных мышцах шеи, конечностей и туловища – через 7-14 дней, в коже и экзокринных железах – через 1-5 дней. Однако имеются наблюдения как мгновенного наступления эффекта, так и отсроченного на 3-4 недели. Через 1-2 месяца после инъекции начинается процесс отрастания новых нервных терминалей от аксонов, где прежде был блокирован транспорт ацетилхолина, с образованием новых функционально активных нервно-мышечных синапсов (так называемый спрутинг), что приводит в конечном итоге к восстановлению мышечных сокращений через 3-6 месяцев после инъекции, но иногда длительность эффекта сохраняется до 1 года и более (рис. 2). Гистологическими исследованиями доказано, что даже после 30 повторных инъекций в одну и ту же мышцу (при лечении, например, фокальных дистоний) не возникает необратимой денервации и атрофий.
Ботулотоксин типа А (БТА) блокирует SNAP-25, самый активный транспортный белок. Вся периферическая синаптическая передача в организме осуществляется с участием транспортных белков, поэтому ботулотоксин способен оказывать воздействие везде, где работают транспортные белки – в мышечной ткани, в экзокринных железах, в болевых рецепторах. Соответственно, клиническая сфера применения ботулотоксина (препараты Диспорт, Ботокс) может включать 4 группы различных синдромов:
- гиперактивность поперечно-полосатых мышц (страбизм, гемифациальный спазм, блефароспазм, спастическая кривошея и другие фокальные дистонии, спастичность, ДЦП, ригидность, гиперфункциональные мимические морщины, тремор, тики и др.);
- гиперактивность мышц сфинктеров (ахалазия кардии, нарушения мочеиспускания – детрузорно-сфинктерная диссинергия, спастический запор, геморрой и трещины прямой кишки, вагинизм);
- гиперфункция экзокринных желез (гипергидроз, гиперсаливация, слезотечение);
- болевые синдромы (миофасциальные и мышечно-тонические синдромы, головная боль напряжения, мигрень, лицевые боли).
Многие из перечисленных показаний официально зарегистрированы в большинстве стран мира (в том числе в России). По другим ведутся или уже успешно завершены клинические испытания по всем правилам доказательной медицины.
Исключительно важной является разработка способов усиления и продления эффекта инъекции, поскольку частые повторные инъекции могут приводить к образованию антител, а также существенно удорожают стоимость лечения. Выявлено, что более стойкие и полные эффекты токсина проявляются при максимальном мышечном сокращении, при достаточной внутриклеточной концентрации ионов кальция (и, возможно, калия), при воздействии низких температур. Поэтому во время подготовки к лечебной инъекции (за 2 недели) пациенту рекомендуется назначить прием препаратов кальция и калия с витамином D, непосредственно перед инъекцией и сразу вскоре после нее – охлаждать область инъекции, а также интенсивно напрягать инъецируемые мышцы в течение 15-30 минут после процедуры.
Физиологические и клинические эффекты ботулотоксина А
К настоящему времени накопились факты, свидетельствующие о том, что эффекты БТА при лечении фокальных дистоний и других неврологических расстройств значительно сложнее и шире, чем временный локальный блок проведения в терминалях a-мотонейронов. По-видимому, имеется блокада как интрафузальных, так и экстрафузальных волокон, что может объяснить более широкую зону действия препарата после локального введения. Предполагается действие токсина и на терминали чувствительных волокон различной модальности. В частности, это может объяснить быстрый анальгетический эффект инъекции БТА. За счет механизма деафферентации рецепторов мышечных веретен и других видов чувствительных систем БТА может оказывать непрямые эффекты на вышележащие отделы ЦНС. При исследовании моторного потенциала выявлено уменьшение латентных периодов его компонентов, снижение активации париетальной коры и каудальной дополнительной моторной области при ПЭТ, изменение реципрокного торможения на уровне спинного мозга у больных с дистонией руки, отдельных компонентов стволовых тригеминальных и слуховых вызванных потенциалов.
Центральные механизмы действия БТА были исследованы нами при лечении больных краниальной дистонией (КД) и цервикальной дистонией (ЦД). В 25% случаев обнаружено дистантное действие: после инъекции препарата в мышцы одной области у больных с мультифокальной дистонией наблюдалось уменьшение дистонических расстройств в других областях. Этот эффект нельзя объяснить диффузией препарата в соседние мышечные группы, так как действие могло проявляться в уменьшении дистонии в отдаленных мышцах (например, уменьшение проявлений писчего спазма при лечении ЦД и КД). При исследовании вызванных брюшных рефлексов было показано достоверное снижение интернейронной гиперактивности, характерной для дистонии, хотя и не достигающее нормальных показателей после первой инъекции. Уменьшение возбудимости спинальных интернейронов может свидетельствовать о воздействии БТА на нейрональные системы ЦНС через снижение афферентного потока к спинному мозгу.
Такое опосредованное влияние ботулотоксина на стволовые и спинальные интернейроны может быть одним из наиболее вероятных объяснений дистантных эффектов, наблюдающихся в терапевтической практике. Ясно, что механизм действия ботулотоксина шире, чем только локальное миорелаксирующее действие. Клинические ремиссии в течении дистонии, нередко вызываемые инъекциями препарата, также, возможно, обусловлены тем, что вызываемая этим препаратом деафферентация рецепторов мышечных веретен способна привести к перестройке в нейродинамическом субстрате дистонии. Это позволяет считать БТА средством не только симптоматического, но и патогенетического лечения дистонии. Воздействие БТА на афферентные механизмы подтверждается также динамикой болевых проявлений: боль исчезает раньше, чем проявляется полное миорелаксирующее действие препарата.
Во время беседы с пациентом и/или его родственниками необходимо объяснить механизм действия и влияние препарата на основные симптомы заболевания. Очень важно поставить реальные цели планируемой инъекции, которые при каждой нозологической форме могут быть различными: уменьшение спазма и боли, увеличение объема движений, улучшение качества жизни, расширение социальной активности, самообслуживания, эстетический эффект и т.д. Не следует поддерживать иллюзорную мечту о “волшебном” излечении после однократной инъекции дорогостоящего препарата. Наоборот, в тех случаях, когда необходимы повторные инъекции (а это большинство случаев), следует заранее обсудить этот вопрос с больным. Важно предупредить об ожидаемых (прогнозируемых) временных побочных эффектах, которые связаны не столько с самой процедурой, сколько с особенностями действия препарата при той или иной нозологической форме. Тогда при возникновении побочных эффектов пациент легче их перенесет.
Перед проведением лечения пациенту необходимо ознакомиться с протоколом информированного согласия и заполнить его, обсуждая неясные положения с лечащим врачом. Эта необходимая этическая процедура вносит дополнительные гарантии успеха лечения. Когда это возможно, следует провести видеозапись или фотографирование первоначального состояния пациента, а затем повторить при динамическом осмотре после инъекции. Это является документальным подтверждением результативности лечения, особенно важным для тех пациентов, которые недооценивают его результаты. Кроме того, анализ видеозаписей помогает планировать выбор мышц пациента для последующих инъекций.
Помещение, в котором проводится инъекция, должно быть хорошо освещенным, теплым, просторным, чтобы можно было осмотреть больного в полный рост, раздетым, и оценить характер двигательных функций в процессе ходьбы. Желательно, чтобы пациент или его родственники наблюдали процесс подготовки раствора препарата и его дозирования в шприце. Следует приветствовать, если больные обсуждают с врачом план лечения и даже выбор мышц для инъекции. Как правило, анестезии для проведения внутримышечных инъекций не требуется даже детям. Поверхностная анестезия лидокаин-спреем или гелем “EMLA” проводится перед внутрикожным введением препарата при лечении гипергидроза.
Первичная неэффективность встречается исключительно редко – менее 0,1% после впервые проведенной инъекции. Всегда бывает очень трудно сделать заключение о первичной резистентности к препарату, так как нет объективных методов, абсолютно подтверждающих факт нечувствительности к препарату. Если повторная инъекция (через 2 месяца после первой) в той же дозе и в те же точки не окажет эффекта (объективно и субъективно), можно с большой вероятностью сделать заключение о первичной резистентности. Вторичная резистентность (возникающая после повторных инъекций препарата и являющаяся следствием появления нейтрализующих антител к БТА) может быть полной и частичной, объективной и субъективной, постоянной и временной. Роль антител составляет менее 10% от общего числа всех причин терапевтических неудач.
Гораздо чаще причиной неудовлетворительного результата инъекции является недостаточная доза препарата или неточный выбор мышц для инъекции.
Ботулотоксин в неврологической практике
Ботулинотерапия двигательных расстройств представляет сегодня отдельный, хорошо изученный раздел неврологии. Научным и клиническим аспектам ботулотоксина посвящено множество исследований и фундаментальных монографий, в том числе в России. Не будет преувеличением сказать, что именно начало применения ботулотоксина дало всплеск интереса к изучению патофизиологии фокальных дистоний и других дискинезий.
Фокальные дистонии. Термин “дистония” используется для описания неврологического синдрома, характеризующегося продолжительными мышечными сокращениями, часто приводящими к повторяющимся деформирующим движениям и устойчивым патологическим позам в вовлеченных областях тела. История изучения клиники, морфологии, этиологии и патофизиологии дистонии насчитывает более ста лет, с того момента, когда в 1887 г. H. Wood в учебнике по нервным болезням описал лицевую и оро-мандибулярную дистонию. С 1983 г. для лечения дистонии стали использовать высокие дозы холинолитиков, в 1985 г. А. Scott впервые применил локальные инъекции ботулотоксина для лечения блефароспазма. В 1989 г. Ozelius локализовал ген аутосомно-доминантной дистонии на хромосоме 9q32-34.
Наиболее распространенными формами фокальных дистоний являются краниальная дистония (КД), включающая синдромы блефароспазма, оро-мандибулярной дистонии, ларингеальной и фарингеальной дистонии, цервикальная дистония (ЦД), писчий спазм (ПС) и другие “профессиональные” дистонии (у машинисток, телеграфистов, музыкантов и др.). Редкой формой является фокальная дистония стопы. Фокальные дистонии поражают лиц трудоспособного возраста, высока степень социальной дезадаптации и инвалидизации больных вследствие формирования у них выраженного функционального дефекта (функциональной “слепоты” при блефароспазме, нарушения речи, жевания и глотания – при оро-мандибулярной и фарингеальной дистонии, голосообразования – при ларингеальной дистонии, удержания головы в прямом положении – при цервикальной дистонии, нарушения письма – при писчем спазме и т.д.).
Подавляющее большинство больных как с идиопатической, так и с симптоматической дистонией нуждаются в терапии, являющейся неспецифической и воздействующей на симптомы, а не на причины заболевания, которые до сих пор остаются нераскрытыми. Неспецифическая терапия может быть подразделена на три типа:
- системная и местная фармакотерапия;
- хирургические вмешательства;
- физические методы и методы поведенческой модификации, обратная связь и другие виды афферентных и релаксационных воздействий.
Для лечения дистонии применялись различные группы препаратов, воздействующих на обмен дофамина, катехоламинов, ацетилхолина, серотонина, ГАМК и других биологически активных веществ. Практика показывает, что их средняя терапевтическая эффективность не превышает 20-30%, и их влияние носит, как правило, временный характер. Наилучшие результаты в отдельных случаях достигнуты при применении холинолитиков (дексэтимида, тригексифенидила, триперидена, биперидена), а также сочетания препаратов ГАМК-ергического действия клоназепама и баклофена. Значительно меньшую роль в лечении дистонии играют нейролептики, агонисты дофамина и другие препараты, особенно в сравнении с терапией ботулотоксином.
Хирургические методы лечения включают стереотаксические операции (таламотомию, паллидотомию), высокочастотную стимуляцию ядер таламуса и бледного шара, а также периферические операции (цервикальную радикотомию, декомпрессию добавочного нерва, селективную денервацию и ризотомию, миоэктомию). Однако лечебный эффект этих воздействий часто носит временный характер, к тому же сопряжен с высоким риском функциональных нарушений, особенно после двусторонних операций на головном мозге (парезы, дизартрия, дисфагия, психические нарушения). Обычно хирургическое лечение применяется в случаях стойкой терапевтической резистентности к системной и локальной фармакотерапии. К методам локальной денервационной фармакотерапии относятся внутримышечное введение препаратов ботулинического токсина, спирт-новокаиновой смеси и фенола. Инъекции фенола имеют побочные эффекты в виде стойких дизестезий, поэтому не получили широкого распространения, несмотря на низкую стоимость. Спиртовые блокады болезненны, и их эффект кратковременен.
Наиболее распространенным в мире способом лечения фокальных дистоний являются повторные локальные инъекции токсина ботулизма. Предпочтительнее, чтобы лечение фокальных дистоний ботулотоксином проводил врач-невролог, специализирующийся и имеющий опыт и интерес в области двигательных расстройств, поэтому следует приветствовать организацию амбулаторных клинических центров двигательных расстройств и ботулинотерапии, каковым в России неформально, но по сути является Клиника нервных болезней им. А.Я. Кожевникова ММА имени И.М. Сеченова. Дозировки препаратов БТА и единицы активности Диспорта и Ботокса (измеряемые в мышиных единицах действия) индивидуальны, но в клинической практике наиболее оптимальным является соотношение Диспорт : Ботокс = 3-4 ЕД : 1 ЕД. Оптимальная доза для локального внутримышечного введения при лечении блефароспазма составляет 120-200 ЕД Диспорта на 1 процедуру, при лечении спастической кривошеи – 500-800 ЕД Диспорта (на 1 процедуру). Инъекции повторяются 2-3 раза в год, однако нередки случаи, когда повторные инъекции индуцируют ремиссию в течении заболевания и последующие инъекции могут производиться по мере необходимости (иногда 1 раз в 2-3 года).
Настоящая статья не является методическим руководством по применению ботулотоксина, поэтому мы не приводим в данной публикации всех деталей процедуры, которые изучаются на специальных тренингах для врачей-неврологов. Но для примера – дозировки (табл. 1) и точки инъекций (рис. 3) раствора препарата Диспорт при лечении блефароспазма и цервикальной дистонии.
Таблица 1. Дозировка Диспорта при блефароспазме
| Доза | Начальная: 120 единиц на каждый глаз Повторная: может быть снижена до 80 единиц на каждый глаз |
| Разведение препарата | 2,5 мл 0,9% NaCl |
| Содержание едениц | 200 единиц в 1 мл 20 единиц в 0,1 мл |
| Введение | Подкожное |
| Инъекцируемые мышцы | Верхняя и нижняя орбитальная мышца каждого глаза Внутренняя часть: 20 едениц (0,1 мл) Наружная часть: 40 единиц (0,2 мл) |
| Точки инъекций | По 4 точки на каждый глаз Не инъекцировать центр верхнего века |
Начальной рекомендуемой дозой при лечении цервикальной дистонии является 500 ЕД Диспорта. Препарат разводится в 1 мл р-ра хлорида натрия. Инъекции проводятся внутримышечно. Общая доза разделяется соответственно в зависимости от состояния пораженных мышц и типа кривошеи.
Гемифациальный спазм (ГФС) – периферический миоклонический гиперкинез, проявляющийся кратковременными непроизвольными сокращениями мышц одной половины лица, иннервируемых лицевым нервом (все мимические мышцы, m. platyzma и m.stapedius в среднем ухе). Самая частая причина ГФС – раздражение или компрессия корешка лицевого нерва в месте его выхода из Варолиева моста аномально расположенной артерией на основании мозга. Кроме того, другие процессы в области мосто-мозжечкового угла (опухоль) могут проявляться симптомами ГФС, поэтому нейровизуализация (МРТ головы) должна проводиться каждому пациенту для исключения объемного процесса. ГФС возникает в зрелом возрасте, чаще у женщин, и в 70-90% – на левой половине лица. Стойкий эффект может дать хирургическое лечение – микроваскулярная декомпрессия, однако операция на задней черепной ямке всегда связана с риском для жизни. Инъекции ботулотоксина являются средством выбора для большинства больных ГФС. Тактика инъекций – такая же, как при блефароспазме, но только с одной стороны. Доза Диспорта – 60-100 ЕД на 1 процедуру.
Лечение спастичности и детского церебрального паралича – всегда этапное, комплексное, предпочтительнее, чтобы оно проводилось в специализированных центрах, где ботулотоксину отведена своя ключевая роль в ряду других реабилитационных методик.
Задачи лечения ботулотоксином спастичности у взрослых должны быть реалистичными: улучшение функциональных возможностей, лечение боли и мышечных спазмов, облегчение физиотерапевтических занятий, облегчение ухода за обездвиженным больным, устранение косметического дефекта, улучшение функциональных возможностей в лечении нарушений мочеиспускания (спазм сфинктера); в итоге – как можно более ранняя активизация больного.
Функциональные результаты применения БТА в лечении спастичности очевидны: увеличение скорости ходьбы, длины шага, увеличение функциональных возможностей руки, улучшение управления инвалидной коляской, облегчение обслуживания обездвиженных больных, предупреждение скелетно-мышечных осложнений (контрактур, подвывихов, мышечных спазмов и др.) и косметических дефектов. Цели лечения спастичности при ДЦП можно разделить на краткосрочные и долгосрочные.
Краткосрочные – улучшить функцию конечности, уменьшить боль и дискомфорт, улучшить самообслуживание. Долгосрочные – предотвратить изменения в мышечной ткани, удлинить мышечные волокна, улучшить рост конечности, предотвратить развитие динамичных и фиксированных контрактур, предотвратить изменения в сухожилиях, деформации и дистопии суставов и скелета в более позднем периоде, избежать или отодвинуть сроки операции. Применение ботулотоксина при ДЦП показано при относительной сохранности функции мышц, в случаях динамичной (не фиксированной) контрактуры, при возможности использования в реабилитации функции мышц синергистов и антагонистов, при сохранности мотивационного поведения.
Приказом МЗ и СР от 29.11.2004 № 288 приняты амбулаторно-поликлинические стандарты медицинской помощи больным детским церебральным параличом. В России ботулотоксин включен в обязательном порядке в стантарт лечения ДЦП.
Ботулотоксин в эстетической неврологии
Инъекции препаратов токсина ботулизма для временного устранения мимических морщин лица в настоящее время являются очень распространенной эстетической процедурой.
Однако при всей простоте и очевидности эстетического результата процедура инъекции ботулотоксина – это всегда воздействие на нервную систему, от периферической нервной терминали до центральных ее отделов, поэтому вмешательство в деятельность нервной системы требует от врача-эстетиста как дополнительной ответственности, так и дополнительных неврологических знаний. Эта важнейшая область эстетической медицины в полной мере является эстетической неврологией.
В эстетической медицине ботулотоксин наиболее широко используется для коррекции мимических морщин, возникающих вследствие гиперактивности мимических мышц.
Основная функция мимических мышц – невербальная коммуникация, передача эмоций человека или, наоборот, попытка скрыть их с помощью сознательного сдерживания мимических движений. У детей и лиц молодого возраста складки кожи, связанные с мимическим движением мышц при смехе, плаче, огорчении, внимании, гневе и других эмоциях, расправляются тотчас же после окончания сокращения соответствующих мышц.
У взрослых в тех участках, где наиболее часто возникают складки, образуются морщины, имеющие индивидуальный рисунок у каждого человека. Помимо мышечных сокращений, на степень образования морщин влияют такие факторы, как действие гравитации, внешней среды, инсоляции, состояние подкожной соединительной ткани, водно-солевой баланс и алиментарный фактор, а также профессиональная деятельность, психические особенности и многое другое.
Мимические мышцы верхней половины лица, имеющие большое “терапевтическое окно”, являются областями оптимальной коррекции ботулотоксином. Типичные морщины в этой зоне – горизонтальные складки на лбу, вертикальные складки на переносице (“морщины гнева”) и радиальные морщины вокруг глаз (“гусиные лапки”). Мышцы нижней половины лица по сравнению с верхней имеют меньшее терапевтическое “окно” для ботулотоксина, поэтому коррекция мимических складок нижней половины лица нередко сопряжена с риском развития нежелательной слабости мышц, нарушения улыбки и артикуляции и на практике применяется гораздо реже, чем коррекция верхней половины лица.
Оценка деталей анамнеза и неврологического статуса является необходимым и важным этапом перед проведением процедуры инъекции ботулотоксина, поскольку мимические морщины могут отражать нарушения как периферической, так и центральной иннервации лицевых мышц. При осмотре нередко обнаруживается асимметрия лица, поэтому для решения вопроса о том, является ли она исходной, физиологической, или приобретенной вследствие травм, операций, поражения лицевого нерва при манипуляциях на лице, невропатии лицевого нерва, герпетического поражения и других причин, необходимо детально изучить анамнез и проверить силу мимических мышц и симметричность их сокращения во время выполнения стандартных мимических проб.
Нейропатия лицевого нерва (НЛН) – довольно распространенное заболевание. Основные причины поражения лицевого нерва – инфекционно-аллергические, компрессионно-ишемические, травматические. В настоящее время возросло количество пациентов с поражением лицевого нерва за счет увеличения числа бытовых и огнестрельных травм, онкологических заболеваний, патологии околоушной слюнной железы и осложнений после проведения пластических и реконструктивных операций и косметических манипуляций. НЛН характеризуется выпадением как произвольных, так и непроизвольных движений мимических мышц, утратой рефлексов, мышечной атонией и дегенеративной атрофией мышц. Внешне это проявляется асимметрией лица, которая может возникать не только при мимике, но и в состоянии покоя. У пациентов возникают серьезные физические, функциональные нарушения, снижающие качество жизни.
Нарушается эстетическое восприятие лица, что приводит к психологической травме, дезадаптации в обществе.
Лечение НЛН проводится в зависимости от этиологии, выраженности, длительности как консервативно, так и хирургическим путем. Но даже при успешном результате лечения сложно добиться полного восстановления функции мимических мышц, и асимметрия лица может остаться. По полученным нами данным клинического исследования и электронейромиографии (ЭНМГ), страдает не только пораженная сторона лица, но и здоровая. В паретичных мышцах формируются контрактуры и синкинезии; на здоровой стороне – гипертонус мимических мышц, усугубляющий асимметрию. Поэтому необходимо проводить коррекцию выявленных нарушений как на пораженной, так и на здоровой стороне. Ботулотоксин вводится в гипертоничные мышцы здоровой стороны и в зоны контрактур и синкинезий на пораженной стороне.
Одним из важных направлений эстетической неврологии является лечение потливости. По статистике гипергидроз встречается у мужчин в 1,5 раза чаще, чем у женщин. По причинам возникновения гипергидроз подразделяют на первичный (так называемый эссенциальный) и вторичный (на фоне других заболеваний). По распространенности гипергидроз может быть генерализованным и локальным. Эссенциальный гипергидроз – самая частая форма расстройств потоотделения, чаще встречается локальный гипергидроз в области подмышечных впадин, ладоней и стоп. У пациентов с эссенциальным гипергидрозом отмечено как увеличение количества потовых желез, так и повышение их реакций на обычные, даже несущественные, стимулы. Как правило, эссенциальный гипергидроз проявляется с детства, резко усиливаясь в пубертатный период.
Прежде чем поставить диагноз эссенциального (первичного) гипергидроза, необходимо исключить целый ряд заболеваний неврологической, эндокринной и соматической природы, вызывающих вторичный гипергидроз. В последние годы во всем мире наиболее популярным способом лечения локального гипергидроза стало внутрикожное введение ботулотоксина. После лечения никогда не возникает компенсаторный гипергидроз.
Ботулотоксин может применяться для лечения всех видов локального гипергидроза, как первичного, так и вторичного, в том числе и таких редких форм, как гипергидроз лица, головы, паховой области.
Важным направлением эстетической неврологии является анализ причин побочных эффектов и нежелательных явлений. Природа побочных эффектов может быть различной, нередко побочные эффекты проявляют имеющуюся скрытую патологию, в частности, асимметрия воздействия может выявить патологию лицевого нерва, а головная боль может свидетельствовать о вовлечении системы тройничного нерва или компенсаторном напряжении затылочных мышц. Во всех случаях возникновения нежелательных явлений первым шагом должно стать выявление диагностически значимых побочных эффектов и дальнейшее неврологическое обследование, а затем уже коррекция, если это возможно, эстетических недочетов.
Неадекватный или несимметричный эффект инъекции, даже в случаях корректного введения и правильно рассчитанной дозы, может быть связан с рядом обстоятельств: асимметрия строения мышц, слабость соединительной ткани, состояние после перенесенных операций, эндокринные и метаболические нарушения, фаза менструального цикла (нежелательно делать инъекцию во время менструации) и др. Поэтому правилом должно быть стремление достичь не максимально возможного, а оптимального эстетического эффекта. Таким образом, в эстетической неврологии приоритетным становится диагностическое направление, позволяющее врачу-косметологу на ранних стадиях заподозрить возможное неврологическое расстройство и принять своевременные меры. В этом смысле инъекция ботулотоксина является не только проверенным и надежным лечебным и эстетическим средством, но и важным диагностическим методом.
В МЗ и СР РФ зарегистрированы технологии по применению препарата Диспорт в эстетической медицине (рис. 4).

Ботулотоксин при болевых синдромах
Мигрень – одно из самых известных и распространенных неврологических заболеваний, встречается во взрослой популяции со средней частотой 12% (6% у мужчин и 18% у женщин) и 4% – в детском возрасте. Исследования последних лет показали эффективность препаратов ботулотоксина при различных болевых синдромах, включая нейропатическую боль, боль в спине, боли при “хлыстовых” травмах, а также мигрени и других типах хронических головных болей.
Хотя мигрень не является опасным для жизни заболеванием, она значительно снижает качество жизни пациентов. Всемирная Организация Здравоохранения относит мигрень к группе наиболее дезадаптирующих хронических заболеваний. Высокоэффективным стало лечение приступов мигрени с введением в широкую клиническую практику 5-HT1B/1D-агонистов, известных как триптаны. К профилактическому (превентивному) лечению мигрени, напротив, относятся настороженно, часто пренебрегая им. Показано, что только 3-5% пациентов с мигренями, которые нуждаются в профилактическом лечении, действительно получают такую помощь. Использование ботулинического токсина типа А (БТА) является новым подходом в профилактике головных болей, учитывая хорошую переносимость лечения, безопасность, отсутствие системных побочных эффектов и большую продолжительность действия – характеристики, которые очень выигрышны для продолжения использования в клинической практике.
Впервые эффективность БТА при головных болях была отмечена пластическим хирургом William Binder, когда многие из его пациентов, получавшие инъекции ботулотоксина для коррекции мимических морщин межбровной области, отметили уменьшение частоты и тяжести головных болей. После этих начальных наблюдений было проведено мультицентровое открытое исследование БТА у пациентов с мигренью, что дало толчок к бурному интересу в этой области.
При мигрени препараты ботулотоксина типа А обычно вводят в область glabella, височные, лобные и иногда затылочные области. Используют несколько методик: “фиксированных точек”; “следуя за болью” (“follow the pain”), когда выбор точек для инъекций зависит от локализации боли или мышечного напряжения; или их комбинацию.
Перед инъекций уточняется “анатомическая” локализация боли и пальпируются перикраниальные мышцы, мышцы заднелатеральной области шеи и плечевого пояса для выявления зон мышечного напряжения. Выбор методики введения БТА во многом зависит от жалоб пациента и данных врачебного осмотра. Методика “фиксированных точек” чаще применяется при мигрени, а методика “следуя за болью” – при головных болях напряжения; оба подхода используются при смешанных головных болях.
Предложено несколько теорий антиноцицептивного влияния ботулотоксина:
- Ослабляя длительное мышечное сокращение, ботулотоксин может уменьшать высвобождение различных веществ, приводящих к сенситизации мышечных ноцицепторов.
- Воздействуя на активность мышечных веретен, ботулотоксин может опосредованно (непрямое действие) уменьшать мышечную боль, связанную с избыточным мышечным сокращением. Поскольку афференты мышечных веретен имеют важные супраспинальные проекции, изменение их активности после инъекций ботулотоксина может изменять активность сенсорных систем на уровне ЦНС.
- Ботулотоксин может подавлять нейрогенное воспаление, роль которого обсуждается в патогенезе мигрени и других болевых синдромов.
- Ботулотоксин может нарушать высвобождение не только ацетилхолина, но и других нейротрансмиттеров. Имеются доказательства, что БТА ингибирует высвобождение субстанции Р in vitro. In vivo показано влияние БТА на болевое поведение крыс, что связывают с уменьшением высвобождения глютамата.
Клинические и доклинические исследования указывают, что БТА может воздействовать на многих этапах патофизиологического каскада при головных болях, хотя не ясно, какой этап считать наиболее важным.
Использование БТА при других первичных головных болях, таких как головные боли напряжения, кластерные головные боли, хроническая пароксизмальная гемикрания, также требует продолжения исследований. Для практикующих врачей, регулярно сталкивающихся с проблемой головной боли, препараты БТА становятся ценным лекарственным средством при лечении пациентов с тяжелыми приступами мигрени и хронической мигренью.
Ботулотоксин активно и успешно используется в лечении миофасциальных болевых синдромов (синдром плече-лопаточной периартропатии, верхней апертуры грудной клетки, боль в спине, теннисный локоть, миофасциальный болевой синдром лица). Российские неврологи в этом пионерском направлении достигли значительных успехов, что отражено в публикациях последних лет.
Фармакоэкономические аспекты и государственные гарантии лечения ботулотоксином
Препарат Диспорт включен в Приказ Министерства здравоохранения и социального развития Российской Федерации № 665 от 18 сентября 2006 г. “Об утверждении Перечня лекарственных средств, отпускаемых по рецептам врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи” и входит в раздел “Средства, применяемые по решению врачебной комиссии, утвержденному главным врачом лечебно-профилактического учреждения”.
Препарат Диспорт зарегистрирован по следующим показаниям:
- Блефароспазм
- Гемифациальный спазм
- Спастическая кривошея
- Спастичность руки после инсульта
- Динамическая деформация стопы, вызванная спастичностью, у детей с ДЦП c 2-х летнего возраста
- Лечение гиперкинетических (мимических) складок (морщин) лица.
Один флакон препарата Диспорт содержит 500 единиц, и этой дозировки достаточно для лечения одного пациента с ДЦП или для лечения одного пациента со спастической кривошеей. В зависимости от результатов терапии инъекции должны повторяться каждые 3-6 месяцев. Применение препарата Диспорт позволяет врачам быстро добиться расслабления мышц у пациентов с дистониями и спастичностью и вернуть им радость движения. Единицы активности препарата Диспорт уникальны и неэквивалентны единицам других ботулинических токсинов. Срок годности препарата 2 года.
Компания Ипсен уделяет много времени образованию врачей и регулярно проводит научно-практические конференции и сертификационные курсы. На сегодняшний день сертифицировано более 500 врачей-неврологов во всех регионах России. Все специалисты России, которые имеют сертификаты на применение Диспорта, прошли обучение и регулярно повышают свои профессиональные навыки, и тысячи счастливых пациентов являются подтверждением их профессионализма.
Автор: Орлова О.Р.
Источник: Русский Медицинский Журнал, 2006, том 14, N 23


